Wie die Natur Luftsauerstoff zu Wasser reduziert und dabei Energie speichert
Forschungsbericht (importiert) 2015 - Max-Planck-Institut für Biophysik
Als die ersten Lebewesen auf der Erde entstanden, fanden sie eine reduzierende Atmosphäre vor. Molekularer Sauerstoff (O2, Dioxygen) war allenfalls durch Fotolyse des Wassers durch UV-Licht in Spuren vorhanden. Dies änderte sich, als die unmittelbaren Vorfahren der Cyanobakterien vor etwa drei Milliarden Jahren die oxygene, sauerstoffproduzierende Fotosynthese erfanden.
Weil der freigesetzte Sauerstoff reaktive Formen ausbilden kann und partiell reduzierter Sauerstoff äußerst toxisch ist, führte diese Erfindung zur größten Umweltkatastrophe, welche die Welt je erlebt hat. Um mit dieser Bedrohung fertig zu werden, mussten die Organismen entweder in sauerstofffreien Nischen leben, oder die reaktiven Sauerstoffspezies entgiften und Sauerstoff zu Wasser reduzieren. Die heute lebenden Organismen verwenden verschiedene Enzymsysteme für die Reduktion des Sauerstoffs zu Wasser: Methanbildende Archaeen benutzen wasserlösliche Flavoproteine [1], Pflanzen und viele Mikroorganismen nutzen neben den Häm-Kupfer enthaltenden Oxidasen eine Cyanid-insensitive alternative Oxidase [2]. Beide Enzyme besitzen zweikernige Eisenzentren, an denen die Reduktion des Sauerstoffs zu Wasser stattfindet. Die bedeutendsten Enzymsysteme, die eine Reduktion von Sauerstoff zu Wasser katalysieren, sind jedoch membranständig. Diese Lokalisation ist bei der Sauerstoffreduktion von Vorteil, weil Sauerstoff im hydrophoben Inneren von Membranen angereichert wird. Die bereits erwähnten Häm-Kupfer enthaltenden terminalen Oxidasen („HCTOs“) sind die wichtigsten Enzyme, die Sauerstoff zu Wasser reduzieren. Sie sind in den Membranen der Mitochondrien zellkernhaltiger höherer Organismen und der zellkernlosen Prokaryonten zu finden. Sie sind dort im Rahmen der Zellatmung die terminalen Oxidasen der Atmungskette.
Zur Umwandlung des Sauerstoffs zu Wasser werden Elektronen und Protonen benötigt. Die Elektronen werden von Cytochrom c (oder bei manchen Prokaryonten auch von Chinolen) von der äußeren Membranoberfläche abgegeben, die Protonen kommen aus dem Inneren der Mitochondrien beziehungsweise der Prokaryonten. Durch diesen vektoriellen Zugang der gegenteilig geladenen Substrate Elektron und Proton entsteht eine elektrische Spannung über die Membran („Membranpotenzial“) und ein Protonengradient. Dadurch wird ein Teil der Energie, die in der Reduktion von Sauerstoff zu Wasser steckt, in Form eines sogenannten elektrochemischen Protonengradienten, auch als protonenmotorische Kraft bezeichnet, gespeichert. Zusätzlich pumpen die HCTOs Protonen über die Membran, so dass die Effizienz der Energiespeicherung noch gesteigert wird. Die in dem elektrochemischen Gradienten steckende Energie wird dazu genutzt, um unter anderem Adenosin-5‘-triphosphat, den universellen Energieträger aller lebenden Organismen, zu synthetisieren. Blausäure und Cyanide sind deshalb tödliche Gifte, weil sie anstelle des Sauerstoffs an das aktive Zentrum der HCTOs binden und somit die Energiegewinnung in tierischen und menschlichen Zellen blockieren. Die bd-Oxidasen bilden eine weitere wichtige sauerstoffreduzierende Enzymfamilie, die in den Membranen der Prokaryonten vorkommt.
Ein Forschungsschwerpunkt der Abteilung Molekulare Membranbiologie liegt auf der Aufklärung der Struktur und der Wirkungsweise der membranständigen Sauerstoffreduktasen. Schon Otto Warburg, Direktor des Kaiser-Wilhelm-Instituts für Zellphysiologie in Berlin-Dahlem, hat sich intensiv mit der mitochondrialen Form der Cytochrom c-Oxidase, einer HCTO, beschäftigt. Dieses Enzym wird nach ihm auch als „Warburg’sches Atmungsferment“ bezeichnet. Im Jahr 1931 erhielt Otto Warburg für „die Entdeckung der Natur und der Funktion des Atmungsferments“ den Nobelpreis für Physiologie oder Medizin. Dennoch sind heute noch viele Fragen, den Mechanismus dieses Enzyms betreffend, unbeantwortet.
Die Häm-Kupfer enthaltenden terminalen Oxidasen

Die Kristallisation eines großen biologischen Moleküls, gefolgt von einer Röntgenstrukturanalyse, ist immer noch die beste Art und Weise, seine Struktur, das heißt die Positionen aller Atome in diesem Molekül, zu ermitteln und darauf aufbauend auch seine Funktion und seine Wirkungsweise im Detail zu verstehen. Es gelang uns bereits 1995, die erste vollständige Struktur einer HCTO zu ermitteln, und zwar die aus dem Bodenbakterium Paracoccus denitrificans [3]. Diese ist der des Menschen überraschend ähnlich. Abbildung 1 zeigt die Struktur dieser HCTO, die zur A-Familie der HCTOs gehört, zusammen mit der cbb3-Oxidase aus Pseudomonas stutzeri, wobei die cbb3-Oxidasen die C-Familie der HCTOs bilden [4].
Die bislang einzige Struktur einer cbb3-Oxidase konnten wir 2010 ermitteln [5]. Beiden Enzymen ist nur die zentrale katalytische Proteinuntereinheit, Untereinheit I beziehungsweise ccoN genannt, gemeinsam. Die Lieferung der Elektronen vom Elektronendonor Cytochrom c, welches sich auf der Außenseite der inneren Mitochondrienmembran beziehungsweise Prokaryontenmembran befindet, erfolgt bei den Enzymen der A-Familie über die zwei Kupferatome enthaltende Untereinheit II, bei den cbb3-Oxidasen über die Cytochrom-haltigen Untereinheiten ccoO und ccoP. Die Kenntnis der Struktur der cbb3-Oxidasen ist auch deshalb von Interesse, weil diese Enzyme essenziell für die humanpathogenen Bakterien Helicobacter pylori und Campylobacter jejuni sind. Mit der Entwicklung von Medikamenten, welche die cbb3-Oxidasen hemmen, könnte man deshalb gezielt die durch Helicobacter hervorgerufenen Magengeschwüre und die von Campylobacter verursachten Durchfallerkrankungen bekämpfen. Des Weiteren sind die cbb3-Oxidasen für die Stickstofffixierung bei Knöllchenbakterien unbedingt notwendig. In den zentralen Proteinuntereinheiten befinden sich Wege, auf denen Protonen, die ja zur Erzeugung von Wasser bei der Reduktion des Sauerstoffs benötigt werden, an das aktive Zentrum des Enzyms gelangen können. Diese Protonentransferwege sind in Abbildung 2 schematisch dargestellt.
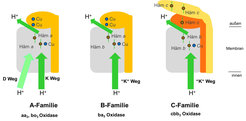
Abb. 2: Schematische Darstellung der A-, B- und C-Familien der HCTOs. Die gemeinsame katalytische Untereinheit ist in Grau dargestellt, die unterschiedlichen Elektronentransferuntereinheiten in Orange/Gelb. Die Protonentransferwege sind mit grünen Pfeilen skizziert.
Die HCTOs der A-Familie besitzen zwei solcher Wege, wobei einer direkt zum aktiven Zentrum führt. Dieser wird nur für den Transport von einem oder zwei Protonen benutzt. Die Protonen, die über die Membran gepumpt werden, benutzen alle einen zweiten Pfad, der auch für den Transfer von zwei oder drei Protonen zum aktiven Zentrum verwendet wird. Die HCTOs der B-Familie sind denen der A-Familie bezüglich der Zusammensetzung ihrer Untereinheiten ähnlich, weisen aber nur einen Protonentransferweg auf. Die Anwesenheit nur eines Protonentransferwegs ist möglicherweise mit einer geringeren Effizienz des Protonenpumpens korreliert [6], dies ist aber noch umstritten. Der Mechanismus des Protonenpumpens selbst ist nur unvollständig verstanden.
Die Reduktion des Luftsauerstoffs ist im Prinzip eine gefährliche Reaktion, weil das O2-Molekül bei Reduktion mit einem Elektron das hochreaktive Superoxid, bei Reduktion mit zwei Elektronen Peroxid bildet. Beide sind sogenannte reaktive Sauerstoffspezies, welche Proteine und Lipide durch Oxidation schädigen. Die HCTOs scheinen die Bildung von reaktiven Sauerstoffspezies dadurch zu verhindern, dass sie gleichzeitig vier Elektronen auf das Sauerstoffmolekül übertragen und so eine sofortige Spaltung der Sauerstoffdoppelbindung bewirken. Zwei Elektronen werden bei den meistuntersuchten HCTOs vom zentralen Eisenatom von Häm-a3, eines vom naheliegenden CuB-Atom und eines von einem Aminosäurerest (Tyrosin280 oder Tryptophan272) geliefert (Abb. 3).

Die bd-Oxidasen
Bei den Prokaryonten sind die bd-Oxidasen weit verbreitet. Ähnlich wie die cbb3-Oxidasen sind sie für die Pathogenizität mancher menschlicher Krankheitserreger essenziell, etwa für die von Mycobacterium tuberculosis, dem Erreger der Tuberkulose. Die bd-Oxidasen nutzen Chinole auf ihrer extrazellulären Seite als Elektronendonor, der Sauerstoff wird an ein Häm-d gebunden, Protonen werden wie bei den HCTOs aus dem Cytoplasma geliefert, so dass eine elektrische Spannung und ein Protonengradient über die Membran entsteht. Erstmals gelang uns in diesem Jahr die Strukturaufklärung einer bd-Oxidase [7]. Sie erbrachte einige überraschende Ergebnisse. So weisen die beiden großen Proteinuntereinheiten einen nahezu identischen Verlauf der Proteinketten auf. Allerdings enthält nur eine von ihnen die drei Häm-Gruppen und somit das katalytische Zentrum für die Sauerstoffreduktion. Das bedeutet, dass dieses Enzym ursprünglich aus zwei identischen Proteinketten bestand, also ein Homodimer war, welches nach Genduplikation in ein Heterodimer umgewandelt wurde. Weiterhin wurde eine dritte, kleine Proteinuntereinheit entdeckt (Abb. 4).
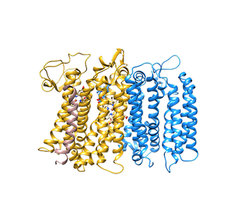
Abb. 4: Ein Überblick der molekularen Struktur der Cytochrom bd-Oxidase. Die Untereinheiten CydA (gelb), CydB (blau) und CydS (rosa) sind als Bändermodell dargestellt. Die beiden Häm-b-Moleküle sind in Beige und das Häm-d-Molekül in Blau als Stäbchenmodell dargestellt.
Die Anordnung und Reihenfolge der Häm-Gruppen widerspricht allen Erwartungen. Man hatte erwartet, dass die drei Häm-Gruppen in Form einer linearen Kette angeordnet sind, wobei das Sauerstoff-bindende Häm-d am Ende der Kette liegen sollte [8]. Tatsächlich sind die Häm-Gruppen in Form eines Dreiecks angeordnet (Abb. 3). Häm-d bildet die Spitze des Dreiecks, es erhält die zur Sauerstoffreduktion notwendigen Elektronen von Häm-b558. Vom Häm-d können sie an Häm-b595 weitergeleitet werden. Sind alle Häm-Gruppen reduziert, können die Elektronen auf den gebundenen Sauerstoff übertragen werden. Aufgrund der zentralen Lage des Häm-d kann der für die Spaltung des Sauerstoffmoleküls notwendige Transfer von vier Elektronen simultan stattfinden. Spektroskopische Untersuchungen [9] schlagen vor, dass zwei Elektronen von dem zentralen Eisenatom des Häm-d, eines vom Häm-b595 und das vierte aus dem Elektronensystem des Häm-d-Makrozyklus geliefert werden. Durch den simultanen Elektronentransfer sind auch die bd-Oxidasen in der Lage, die Bildung der reaktiven Sauerstoffspezies Superoxid und Peroxid zu verhindern. Vergleicht man die HCTOs und die bd-Oxidasen funktionell, so entspricht Häm-a der HCTOs dem Häm-b558 der bd-Oxidasen, das Sauerstoff-bindende Häm-a3 dem Häm-d und das Kupferatom CuB dem Häm-b595.
Der einzige Unterschied scheint zu sein, dass das vierte Elektron bei den HCTOs von einer Aminosäure, bei den bd-Oxidasen vom Häm-d-Makrozyklus stammt. Die Analogie zwischen HCTOs und bd-Oxidasen geht noch weiter: In beiden Systemen befindet sich ein Tryptophanrest zwischen der elektronenliefernden und der sauerstoffbindenden Häm-Gruppe (Abb. 3).
Ganz offensichtlich hat die Natur zweimal unabhängig membranständige Enzymsysteme entwickelt, die Luftsauerstoff zu Wasser reduzieren, dabei einen Teil der in dieser Reaktion steckenden Energie speichern und durch den simultanen Transfer von vier Elektronen die Bildung gefährlicher, reaktiver Sauerstoffspezies verhindern. Die Mechanismen im Detail aufzuklären, bleibt eine Aufgabe für die Zukunft.



