GcpE und LytB: Enzyme der Isoprenoid-Biosynthese als Angriffsziele für Wirkstoffe gegen Malaria und Tuberkulose
Forschungsbericht (importiert) 2012 - Max-Planck-Institut für Biophysik
Der DOXP-Weg der Isoprenoidbiosynthese
Isoprenoide, auch Terpenoide genannt, stellen eine große Stoffklasse mit über 35000 bekannten Substanzen hoher Diversität dar, die in allen Organismen lebenswichtige Funktionen ausüben, wie zum Beispiel bei der Regulation der Genexpression und des Immunsystems, bei der Signaltransduktion, der Energiekonservierung oder der Photosynthese. Ein bekanntes Beispiel ist Cholesterin, ein wichtiger Zellmembranbestandteil in Wirbeltieren und Ausgangsstoff zur Biosynthese von Steroidhormonen, wie beispielsweise Cortisol, das unter anderem Immunreaktionen und Entzündungen herunterreguliert. Ferner zu nennen wären Retinal, die als Vitamin A1 aufgenommene Schlüsselsubstanz der visuellen Wahrnehmung, Ubiquinon (auch Coenzym Q genannt) als Elektronenvermittler in der Atmungskette und Chlorophyll als grüner Farbstoff der Pflanzen und wichtigste Substanz der Photosynthese. Trotz ihrer großen strukturellen Vielfalt basiert die Synthese all dieser Stoffe auf zwei einfachen C5-Grundbausteinen, dem Isopentenylpyrophosphat (IPP) und dem Dimethylallylpyrophosphat (DMAPP; Abb. 1), die durch das Enzym IPP-Isomerase (IDI) ineinander überführt werden können. Im Laufe der Evolution haben sich zwei verschiedene Wege für die Synthese von DMAPP und IPP entwickelt: der Mevalonat- und der Desoxyxylulose- 5-phosphat (DOXP)-Stoffwechselweg.
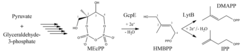
Der Mevalonat-Weg, der von Archeen, Pilzen, Tieren und auch vom Menschen benutzt wird, ist seit vielen Jahren bekannt und hat durch die Entdeckung der Statine, die durch Inhibition der 3-Hydroxy-3-methylglutaryl-Coenzym-A-Reduktase den Cholesterin-Spiegel senken können, Einzug in unser tägliches Leben gefunden [1].
Im Gegensatz dazu wurde der DOXP-Weg erst Anfang der 1980er Jahre entdeckt und kommt in Cyanobakterien, Eubakterien, Algen, Chloroplasten und Apicomplexa - zu den Eukaryonten gehörige Parasiten - vor. Seine Verwendung in einer Reihe von humanpathogenen Erregern, wie beispielsweise dem wichtigsten Tuberkulose-Überträger Mycobacterium tuberculosis oder den Malaria übertragenden Plasmodium-Stämmen hat ihn in den Fokus klinischen Interesses gerückt. Er gilt als vielversprechender Angriffspunkt zur Entwicklung neuer Medikamente, die auch deswegen dringend benötigt werden, weil die Resistenz vieler Erreger gegen gängige Wirkstoffe wirksame Therapien zum Beispiel gegen Malaria zunehmend erschweren [2]. Ferner spielt der DOXP-Weg eine bedeutende Rolle in der Biotechnologie, da er an der Synthese vieler kommerziell interessanter Verbindungen, vor allem in Pflanzen, maßgeblich beteiligt ist. So stellen beispielsweise die Steviolglykoside der Stevia-Pflanze Diterpenoide dar, die aktuell als Alternative zu klassischen Süßstoffen diskutiert werden.
Der DOXP-Weg setzt sich aus sieben biochemischen Reaktionen zusammen, die in den letzten 20 Jahren intensiv untersucht wurden. Als besonders schwierig stellte sich die Erforschung der beiden letzten Reaktionen heraus, die chemisch kompliziert sind und von Enzymen katalysiert werden, die Sauerstoff empfindliche und erst später entdeckte Eisen-Schwefel-Zentren enthalten. Es gelang erst in den letzten Jahren, die Enzyme HMBPP-Synthase (GcpE/IspG) und HMBPP-Reduktase (LytB/IspH) heterolog zu produzieren, das [4Fe-4S]-Zentrum in vitro zu rekonstituieren und grundlegende biochemische und strukturelle Untersuchungen durchzuführen.
GcpE
Das Enzym GcpE - auch IspG genannt - katalysiert den vorletzten Schritt des DOXP-Weges (Abb. 1), also die Umsetzung von 2-C-Methyl-D-erythritol-2,4-cyclo-diphosphat (MEcPP) zu E-1-Hydroxy-2-methyl-but-2-enyl-4-diphosphat (HMBPP). Dabei wird das zyklische MEcPP zwischen C2 und dem β-Phosphat gespalten, nach Bereitstellung zweier Elektronen ein Wassermolekül eliminiert und eine Doppelbindung zwischen C2 und C3 zum linearen HMBPP gebildet.
Um die Bindung seines Substrats und den Ablauf einer Reaktion auf atomarer Ebene zu verstehen, muss die Raumstruktur eines Enzyms aufgeklärt werden. Dies gelang bei GcpE aus Aquifex aeolicus und Thermus thermophilus [3, 4]. Demzufolge liegt GcpE als Homodimer vor, wobei sich jedes Monomer aus zwei Domänen zusammensetzt, die durch ein sechs Aminosäuren langes Verbindungsstück flexibel miteinander verknüpft sind (Abb. 2). Die größere, Substrat-bindende (βα)8-Domäne hat eine Fass-ähnliche Struktur, die aus acht parallelen, kreisförmig angeordneten β-Strängen besteht und am Boden durch den N-terminalen Bereich verschlossen ist. Die Substratbindestelle liegt im Fass unterhalb seiner Öffnung. Die kleinere offene α/β-Domäne stellt die Bindestelle für das [4Fe-4S]-Zentrum dar, das an drei Cysteinen und einem Glutamat aufgehängt ist. Aufgrund der großen Entfernung zwischen der vermuteten Substratbindestelle und dem [4Fe-4S]-Zentrum war zunächst unklar, wie die Elektronen auf das Substrat übertragen werden. Voraussagen und experimentellen Hinweisen zufolge sollte sich die [4Fe-4S]-bindende Domäne nach Bindung des Substrats wie ein Deckel auf die Fassöffnung der (βα)8-Domäne der anderen Untereinheit legen [3, 4] - dies wäre eine bemerkenswerte Konformationsänderung.
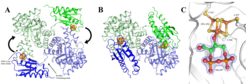
Um diese Vermutung experimentell abzusichern, wurde die Kristallstruktur des GcpE-MEcPP-Komplexes bis zu einer Auflösung von 1,55 Å (0,155 nm) bestimmt (Abb. 2B; 5]. Wie vorhergesagt, lag das Substrat tief in der Fass-förmigen (βα)8-Domäne und die α/β-Domäne des gegenüberliegenden Monomers rotierte als starrer Körper um 60° zur Öffnung des Fasses und verschloss diese weitestgehend. Das flexible Verbindungsstück zwischen den Domänen diente dabei als Scharnier. Bei diesem Prozess wird die Bindung zwischen dem Glutamat und dem apikalen Eisen des [4Fe-4S]-Zentrum gelöst und stattdessen die Bindung zu O3 des MEcPP geknüpft (Abb. 2C). MEcPP wird vor allem durch die starke Wechselwirkung der Diphosphatgruppe mit mehreren positiv geladenen Resten (vier Arginine und ein Lysin) festgehalten. Wir nehmen an, dass über diese Wechselwirkungen eine Konformationsänderung des Helix-Loop-Helix-Halters ausgelöst wird, der die Wechselwirkung zur [4Fe-4S]-Bindedomäne der Partneruntereinheit schwächt und deren 60° Rotation veranlasst. Die strukturellen Daten liefern auch neue mechanistische Informationen, die nun durch gezielten Aminosäurenaustausch beziehungsweise weitere spektroskopische und strukturelle Untersuchungen verifiziert werden müssen.
LytB
LytB, auch IspH genannt, katalysiert den letzten Schritt des DOXP-Stoffwechselwegs, nämlich die Umsetzung von HMBPP in die Grundbausteine der Isoprenoidbiosynthese IPP und DMAPP. In der kinetisch kontrollierten Reaktion entstehen je nach Organismus IPP und DMAPP in einem ungleichen Verhältnis von 3:1 bis 5:1, was den höheren Verbrauch an IPP in weiterführenden Prozessen widerspiegelt. Ebenso wie GcpE katalysiert LytB eine reduktive Dehydroxylierungsreaktion, bei der das [4Fe-4S]-Zentrum zweimal ein Elektron auf die C5-Einheit überträgt und als Folge ein Wassermolekül abgespalten wird. Abschließend wird ein Proton entweder an C1 oder C3 angelagert (vgl. Abb. 1).

LytB kann je nach Organismus als Monomer oder Dimer in der Zelle vorkommen. Die Raumstruktur des Aquifex aeolicus und Escherichia coli Enzyms zeigten, dass das Monomer aus drei strukturell ähnlichen Domänen mit α/β-Struktur besteht ([6, 7]. Jede dieser kleeblattförmig angeordneten Domänen steuert ein Cystein zur Bindung des [4Fe-4S]-Zentrums bei, das in der Mitte des LytB Monomers lokalisiert ist. Das vierte Eisen ist an keine Aminosäure gebunden und dissoziiert bereitwillig bei Präparation und Kristallisation. Die Elektronenübertragung erfolgt über die Rückseite des Monomers entweder durch ein an Ferredoxin gebundenes Eisen-Schwefel-Zentrum oder ein an Flavodoxin gebundenes Flavin. Dagegen liegt die Substratbindestelle, beziehungsweise der Ort der katalytischen Reaktion, an der Vorderseite unmittelbar vor dem [4Fe-4S]-Zentrum (Abb.3).
Die Architektur der Substratbindestelle ergibt, dass die Diphosphatgruppe von HMBPP durch mehrere konservierte, positiv geladene Reste festgehalten wird und die C1-Hydroxylgruppe an das labile Eisen bindet. Diese Hypothese wurde kürzlich durch die Bestimmung der Strukturen von LytB im Komplex mit Substrat und Produkt bewiesen und verfeinert [8-10].
Die detaillierte Strukturaufklärung von GcpE und LytB im Komplex mit ihren Substraten erleichtert die Entwicklung von Inhibitoren, die eventuell zu neuen Medikamenten gegen Malaria, Tuberkulose und andere Infektionen durch gramnegative Bakterien führen können.

![Abb. 2: Struktur des GcpE-Dimers: (A) GcpE von Thermus thermophilus ohne Substrat. Die beiden Monomere (in grün und blau) sind zueinander in einer Kopf-Schwanz-Anordnung orientiert, sodass die Substrat-bindende (βα)8 -Domäne (hellgrün, hellblau) und die [4Fe-4S]-bindende α/β-Domäne (blau, grün) des korrespondierenden Monomers aufeinander zeigen. (B) GcpE mit Substrat MEcPP. Die Substratbindung löst eine Rotation der α/β-Domäne vom Helix-Loop-Helix-Halter zur Öffnung der Fass-förmigen (βα)8 -Domäne aus. (C) Nach der 60° Drehung sind der Sauerstoff an C3 von MEcPP und das apikale Eisen des [4Fe-4S]-Zentrums kovalent miteinander verknüpft. Abb. 2: Struktur des GcpE-Dimers: (A) GcpE von Thermus thermophilus ohne Substrat. Die beiden Monomere (in grün und blau) sind zueinander in einer Kop](https://www.mpg.de/11591098/original-1508156513.jpg?t=eyJ3aWR0aCI6ODQ4LCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MTE1OTEwOTh9--dd81cdcbe0906b3a6faaa156937172e9e6ad1253)
![Abb. 3: Struktur des Aquifex aeolicus LytB-Dimers: Das zentrale [4Fe-4S]-Zentrum ist von drei Domänen (gelb, blau, grün) ähnlicher Größe kleeblattförmig umgeben. In der Röntgenstruktur wurde nur ein [3Fe-4S]-Zentrum gefunden. Abb. 3: Struktur des Aquifex aeolicus LytB-Dimers: Das zentrale [4Fe-4S]-Zentrum ist von drei Domänen (gelb, blau, grün) ähnlicher Größe kleeblattförm](https://www.mpg.de/11591106/original-1508156513.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MTE1OTExMDZ9--7ad3f5d663343701c7ac8b7d2ef6001cc2696142)