Elektrogene und elektroneutrale Katalyse durch dihämhaltige Succinat:Chinon-Oxidoreduktasen
Forschungsbericht (importiert) 2007 - Max-Planck-Institut für Biophysik
Die Abteilung Molekulare Membranbiologie (Direktor: Hartmut Michel) arbeitet an der Aufklärung der Funktion und Wirkungsweise von Membranproteinen und Membranproteinkomplexen auf der Basis von möglichst genau ermittelten dreidimensionalen, atomaren Strukturen. Die Bestimmung dieser Strukturen erfolgt durch Röntgenstrukturanalyse, die Herstellung der dafür nötigen Einkristalle ist ein limitierender Schritt bei diesem Prozess. Für die Herstellung und Reinigung der dazu benötigten Membranproteine werden molekularbiologische und biochemische Methoden eingesetzt.
Innerhalb der Abteilung befasste sich die Arbeitsgruppe Lancaster besonders mit einer weitverbreiteten Superfamilie von Enzymen, die in der inneren Mitochondrienmembran von eukaryontischen Zellen oder in der Cytoplasmamembran von Bakterien verankert sind: den so genannten Succinat:Chinon-Oxidoreduktasen (SQOR). Diese SQOR bestehen aus mehreren Proteinuntereinheiten, die im hydrophilen Teil des Enzymkomplexes zwischen den verschiedenen Organismen hohe Sequenzhomologie besitzen, sich aber je nach Spezies und genauer Enzymspezifizität im membranständigen Teil des Enzymkomplexes insbesondere im Gehalt an gebundenem Häm B unterscheiden. Dort sind entweder zwei, eine oder gar keine Hämgruppe gebunden. Die Mitglieder der Superfamilie katalysieren in vivo entweder im Rahmen der aeroben Atmung die Kopplung der Oxidation von Succinat zu Fumarat an die Reduktion von Chinon zu Hydrochinon, das auch als Chinol bezeichnet wird – dann werden diese Succinat:Chinon-Reduktasen (SQR-Enzyme, „Komplex II“) genannt –, oder sie katalysieren im Rahmen der anaeroben Atmung die entsprechende Reaktion in umgekehrter Richtung, also die Reduktion von Fumarat durch Chinol – dann werden sie als Chinol:Fumarat-Reduktasen (QFR) bezeichnet. Neben der Übertragung von zwei Elektronen werden bei den Einzelreaktionen auch jeweils zwei Protonen übertragen.
QFR-Enzyme findet man bei vielen anaeroben Organismen, so z. B. beim ε-Proteobakterium Wolinella succinogenes, das im Rinderpansen vorkommt. Dieses nichtpathogene Bakterium dient als Modellsystem für verwandte, aber humanpathogene ε-Proteobakterien, wie z.B. Helicobacter pylori und Campylobacter jejuni. Die QFR von W. succinogenes ist ein dihämhaltiges Enzym, das die Oxidation von Menachinol (MKH2) durch Fumarat katalysiert. Diese Reaktion ist der letzte Teilschritt der Fumarat-Atmungskette, bei der das Fumarat den Sauerstoff als terminalen Elektronenakzeptor ersetzt und dies dem Bakterium erlaubt, mit verschiedenen Elektronendonorsubstraten, wie beispielsweise Formiat oder Wasserstoff zu wachsen (Abb. 1A).

Analog zur aeroben Atmung wird auch bei der Fumarat-Atmung die freiwerdende Energie nach der chemiosmotischen Theorie von Peter Mitchell in Form eines elektrochemischen Protonenpotenzials Δp zwischengespeichert. Dieses kann zur Phoshorylierung von Adenosindiphosphat (ADP) mit anorganischem Phosphat zu Adenosintriphosphat (ATP), der „Energiewährung“ der Zelle, verwendet werden.
Während die meisten SQR-Enzyme ein Chinon mit vergleichsweise hohem Redoxpotenzial reduzieren, also eines das sich vergleichsweise leicht reduzieren lässt, wie z.B. Ubichinon, oxidieren die QFR-Enzyme in der anaeroben Atmung ein Chinol mit vergleichsweise niedrigem Redoxpotenzial, das sich entsprechend leichter oxidieren lässt, wie z.B. Menachinol, sodass in beiden Fällen die katalysierte Gesamtreaktion der Succinatoxidation durch Chinon bzw. der Fumaratreduktion durch Chinol jeweils unter Standardbedingungen exergonisch verläuft. Eine wichtige Ausnahme wird weiter unten diskutiert.
Die dreidimensionale Struktur der QFR von W. succinogenes wurde durch Röntgenstrukturanalyse, zunächst bis zu einer Auflösung von 2.2 Angström (Å) bestimmt (für eine Übersicht siehe [1]). Diese Auflösung wurde später auf 1.78 Å verbessert [2]. Zwei Komplexe aus jeweils einer A-, B- und C-Untereinheit bilden ein 260 kDa großes Homodimer (Abb. 1B). Die A-Untereinheit bindet kovalent das Flavinadenindinukleotid (FAD) und bildet auch das katalytische Zentrum der Fumarat-Reduktion, die B-Untereinheit bindet drei verschiedene Eisen-Schwefel-Zentren, und die membranständige C-Untereinheit bindet die beiden zuvor erwähnten Häm B-Gruppen, die aufgrund ihrer relativen Lage zu den hydrophilen Untereinheiten als das proximale Häm bP bzw. das distale Häm bD bezeichnet werden. Außerdem bildet die C-Untereinheit die Stelle der Chinoloxidation in der Nähe von Häm-bD. Durch strukturelle und funktionelle Charakterisierung des Variantenenzyms E66Q, bei dem das in der Nähe liegende protonierbare Glutamat C66 mittels gerichteter Mutagenese durch den nichtprotonierbaren Rest Glutamin ersetzt wurde, zeigten die Wissenschaftler, dass dieses Glu C66 essentiell für die Oxidation von Chinol ist (Abb. 1C).
Die bei der Chinoloxidation frei werdenden Elektronen können über die lineare Kette von sechs prosthetischen Gruppen eines Monomers zum Ort der Fumaratreduktion in direkter Nachbarschaft der FAD-Gruppe übertragen werden. Aufgrund der Orientierung der katalytischen Zentren der mit Protonenfreisetzung verbundenen Chinoloxidation und der mit Protonenbindung assoziierten Fumarat-Reduktion zu unterschiedlichen Seiten der Membran sollte die Chinol-Oxidation durch Fumarat bei Katalyse durch eine solche dihämhaltige QFR ein elektrochemisches Protonenpotential (Δp) erzeugen, also elektrogen sein (Abb. 1C).
Überprüfung der elektrogenen bzw. elektroneutralen Katalyse durch dihämhaltige SQOR
Es gab experimentelle Hinweise darauf, dass dies zumindest in einigen dihämhaltigen SQOR der Fall zu sein schien. So wird die Reaktion in umgekehrter Richtung, also die Oxidation von Succinat durch Menachinon, eine endergone Reaktion unter Standardbedingungen, durch eine dihämhaltige SQOR in Gram-positiven Bakterien wie Bacillus subtilis oder Bacillus licheniformis katalysiert. Die Arbeitsgruppe von Gottfried Unden (Mikrobiologie, Universität Mainz) hatte gezeigt, dass diese Reaktion in Gram-positiven Bakterien durch Protonophore, also durch Substanzen, die die Membran durchlässig machen für Protonen, gehemmt wird, was darauf hinweist, dass sie durch das Protonenpotential Δp über der Membran getrieben wird. Allerdings wurden diese Experimente ausschließlich an ganzen Zellen und isolierten Membranen durchgeführt, und es war bezweifelt worden, dass die beobachteten Effekte spezifisch mit der SQR assoziiert sind.
Die Arbeitsgruppe Lancaster konnte zeigen, dass die dihämhaltige Succinat:Menachinon-Reduktase nach Isolierung aus dem Gram-positiven Bakterium Bacillus licheniformis und nach Einbau in ein künstliches Membransystem – der so genannten Rekonstitution in Proteoliposomen – nur dann in der Lage ist, die Reduktion des löslichen Menachinonanalogons 2-Ethyl-3-Methyl-1,4-Naphthochinon (EMN) zu katalysieren, wenn das Protonophor Carbonylcyanid-m-chlorphenylhydrazon (CCCP) hinzugesetzt wird. Daraus wurde geschlossen, dass die Reaktion selbst bei hohem Überschuss des Edukts nicht hinreichend exergonisch ist, um den Aufbau eines elektrochemischen Protonenpotenzials Δp über der Proteoliposomenmembran zu unterstützen. Um die Triebkraft der Reaktion zu erhöhen, modifizierte die Arbeitsgruppe Lancaster in Zusammenarbeit mit der Arbeitsgruppe von Harald Schwalbe (Organische Chemie, Universität Frankfurt am Main) das Substratchinon, sodass es ein höheres Redoxpotenzial besaß, wie es für das lösliche Ubichinonanalogon EQ-0 der Fall war. Um die Triebkraft der Reaktion in entgegengesetzter Richtung zu erhöhen, wurde das Substrat 2-Methyl-3-Methylamino-1,4-Naphthochinol (MMANH2) entwickelt, mit einem im Vergleich zum EMNH2 und DMNH2 (2,3-Dimethyl-1,4-Naphthochinol) niedrigeren Redoxpotenzial.
Zwei Komponenten tragen zum elektrochemischen Protonenpotenzial Δp bei, zum einen das Membranpotenzial ΔΨ, das durch eine unterschiedliche Anzahl von elektrischen Ladungen beider Seiten der Membran entsteht, und zum anderen der Protonengradient ΔpH. Letzterer wird durch Messungen von pH-Änderungen im Lumen der Proteoliposomen anhand der Absorptionsänderungen des Indikatorfarbstoffs 8-Hydroxy-1,3,6-Pyrentrisulfonat (Pyranin) gemessen, wie in Abbildung 2 (rot) dargestellt.
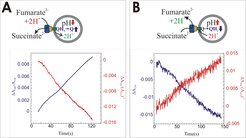
Die Oxidation des Niedrigpotenzialchinols MMANH2 wird ebenfalls photometrisch verfolgt, wie in Abbildung 2A blau dargestellt, und ist mit einer Ansäuerung des Proteoliposomenlumens verknüpft. Entsprechend ist die von der proteoliposomalen SQR katalysierte Reduktion des Hochpotenzialchinons EQ-0 mit einer Alkalisierung des Proteoliposomenlumens assoziiert (Abb. 2B).
Das Membranpotenzial ΔΨ wurde durch Verfolgung der Aufnahme von lipophilen Ionen in die Proteoliposomen mithilfe von Elektroden gemessen, die spezifisch waren für die lipophilen Ionen Tetraphenylphosphonium (TPP+) und Tetraphenylborat (TPB-). Sowohl im Fall der Chinoloxidation als auch im Fall der Chinonreduktion konnte (über die Aufnahme von TPB- bzw. TPP+) die Entstehung eines Membranpotenzials gemessen werden, welches zusammen mit den ΔpH-Messungen die elektrogene Katalyse durch dieses Enzym beweist [3].
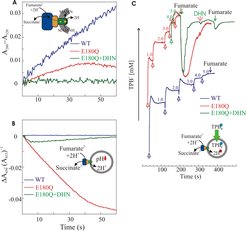
Allerdings wurde bei entsprechenden Messungen mit der QFR von W. succinogenes gefunden, dass Gleiches für dieses Enzym nicht gilt. Während, wie in Abbildung 3 (blau) gezeigt wird, die Oxidation des Niedrigpotenzialchinols MMANH2 unterstützt wird, konnte weder der Aufbau eines Protonengradienten noch eines Membranpotenzials nachgewiesen werden. Die Reaktion war also elektroneutral. Es entstand also das Problem, dass man mit der ermittelten Membranproteinstruktur die Funktionsweise verwandter Enzyme besser erklären konnte als die des Enzyms, dessen Struktur aufgeklärt worden war.
Beweis der „E-Weg Hypothese“ der durch Transmembran-Protonenübertragung getriebenen Transmembran-Elektronenübertragung
Als Arbeitshypothese zur Aufhebung dieser Diskrepanz hatte Lancaster die „E-Weg-Hypothese“ („E-pathway hypothesis“) aufgestellt (Abb. 1D). Danach ist der Elektronentransfer über die Membran in W. succinogenes QFR strikt an die Übertragung von einem Proton pro Elektron vom Periplasma in das Cytoplasma gekoppelt. Der Weg der Protonentranslokation wird transient während der Reduktion der Hämgruppen etabliert und ist in der Struktur des oxidierten Enzyms nicht durchgängig erkennbar. Mögliche Bestandteile des Weges sind das C-Ring-Propionat der distalen Hämgruppe und die Seitenkette von Glu C180, die sich in der Mitte der Membran befindet und dem „E-Weg“ seinen Namen gibt. Dieser Rest ist in den QFR-Enzymen von ε-Proteobakterien konserviert, nicht aber in den dihämhaltigen SQR-Enzymen von Gram-positiven Bakterien.
Seit der Formulierung dieser Hypothese hat die Gruppe theoretische [4] und experimentelle [5] Ergebnisse erhalten, die diese Hypothese stützen. Von zentraler Bedeutung ist hierbei eine gerichtete Mutagenese, bei der das Glu C180 durch Gln ersetzt wurde. Die Mutante E180Q wächst nicht durch anaerobe Respiration mit Fumarat als terminalem Elektronenakzeptor. Mit dem heutigen Kenntnisstand kann man sagen, dass diese Beobachtung die Unverzichtbarkeit des „E-Wegs“ für das Leben unter den Bedingungen der Fumarat-Atmung zeigt. Wenn Fumarat durch Nitrat ersetzt wird, wächst die Mutante und produziert eine QFR-Variante, die von der Arbeitsgruppe isoliert und ausgiebig charakterisiert wurde, unter anderem auch durch Rekonstitution in Proteoliposomen. Analog zur zuvor gezeigten Stimulierung der Chinonreduktionsaktivität der proteoliposomalen SQR von B. licheniformis durch Zugabe des Entkopplers CCCP wird auch die Chinoloxidationsaktivität der proteoliposomalen E180Q-QFR von W. succinogenes durch Zugabe von CCCP ermöglicht. Im Gegensatz zur Wildtyp (WT)-QFR, die nach Rekonstitution in Liposomen zwar die Oxidation des Niedrigpotenzialchinols MMANH2 durch Fumarat katalysiert (blau in Abb. 3A), dabei aber weder eine Änderung der lumenalen Protonenkonzentration (blau in Abb. 3B) noch eine Generierung eines Membranpotenzials (blau in Abb. 3C) verursacht, wurde gezeigt, dass im Fall der E180Q-Variante eine wenn auch vergleichsweise geringere katalytische Aktivität (rot in Abb. 3A) mit einer deutlichen Ansäuerung des Proteoliposomenlumens (rot in Abb. 3B) sowie einer Aufnahme von TPB- in die Proteoliposomen (rot in Abb. 3C) verbunden ist. Diese Ergebnisse belegen klar das Vorhandensein des „E-Wegs“ im Wildtyp-Enzym und die Nichtfunktionalität dieses E-Wegs in der E180Q-Variante [2]. Die Rolle weiterer Reste als mögliche Bestandteile des E-Wegs (Abb. 4A, 4B) sowie die Eintritts- und Austrittsstellen für Protonen werden weiterhin intensiv untersucht.
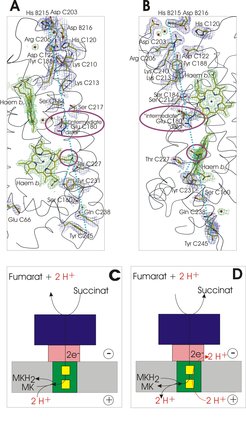
Insgesamt wurde gezeigt, dass die unter Standardbedingungen endergone Oxidation von Succinat durch Menachinon, die durch eine dihämhaltige SQR in B. licheniformis und anderen Gram-positiven Bakterien katalysiert wird, unter Ausnutzung von Δp betrieben wird (Abb. 4C). Umgekehrt ist die bei der Reduktion von Fumarat durch Menachinol freiwerdende Energie offensichtlich nicht ausreichend, um bei dihämhaltigen QFR-Enzymen zum Aufbau eines Protonenpotentials Δp beizutragen. Hier sind offenbar solche Enzyme essentiell, die einen kompensatorischen „E-Weg“ besitzen (Abb. 4D).
![Die Übertragung von Elektronen und Protonen durch Membranproteinkomplexe bei der Fumarat-Atmung (A) und in der QFR von W. succinogenes (B,C,D). Positive und negative Seiten der Membran sind das Periplasma bzw. das Cytoplasma.
(A) Schematische Darstellung der Enzyme der Fumarat-Atmung
(B) Struktur des Homodimers der QFR von W. succinogenes mit je zwei A-, B- und C-Untereinheiten. Die Cα-Ketten der beiden A-Untereinheiten sind in blau und blaugrün, die der beiden B-Untereinheiten in rot bzw. lila, und die der beiden C-Untereinheiten in grün bzw. hellblau dargestellt. Die atomaren Strukturen der sechs prosthetischen Gruppen sind zur besseren Sichtbarkeit in den Vordergrund projiziert. Von oben nach unten sind dieses das Histidyl-FAD, das [2Fe-2S]-, das [4Fe-4S]- und das [3Fe-4S]-Zentrum, die proximale (bP) und die distale (bD) Hämgruppe. C, N, O, P, S und Fe Atome sind gelb, blau, rot, hellgrün, grün bzw. orange dargestellt.
(C) Hypothetische Generierung eines elektrochemischen Protonenpotenzials durch die Orientierung der katalytischen Zentren zu unterschiedlichen Seiten der Membran. Die prosthetischen Gruppen eines Monomers im W. succinogenes-QFR-Dimer sind dargestellt, zusammen mit der Seitenkette des Aminosäurerests Glu C66 (grün) und eines Modells der Bindung von Menachinol (MKH2, rot) sowie des gebundenen Fumarats.
(D) Hypothetischer Co-Transfer von einem Proton (H+) pro Elektron (e-) über die Membran („E-Weg-Hypothese“). Die zwei bei der Oxidation von Menachinol freiwerdenden Protonen werden in das Periplasma (unten) über den Rest Glu C66 freigesetzt. Zur Kompensierung der Elektronenübertragung über die beiden Hämgruppen werden Protonen vom Periplasma über die C-Ring-Propionatgruppe der distalen Hämgruppe bD und der Seitenkette von Glu C180 in das Cytoplasma (oben) übertragen, wo sie die bei der Reduktion von Fumarat gebundenen Protonen ersetzen. Im oxidierten Zustand des Enzyms ist der „E-Weg” blockiert. Die Übertragung von Elektronen und Protonen durch Membranproteinkomplexe bei der Fumarat-Atmung (A) und in der QFR von W. succinogenes (B,C,D). Positi](https://www.mpg.de/365517/original-1293750428.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MzY1NTE3fQ%3D%3D--967dc50056e0c90ac273160592f6eb9003c50470)


![Der „E-Weg“ in dihämhaltiger QFR. Das Periplasma befindet sich in den Abbildungen unten, das Cytoplasma oben;
(A), (B) Orthogonale Ansichten von möglichen Elementen des „E-Wegs” wie in dem bei 1.78 Å Auflösung verfeinerten Strukturmodell der QFR von W. succinogenes. Zur Erleichterung der Orientierung zwischen den beiden Ansichten verbinden gestrichelte hellblaue Linien die Hydroxylgruppe des Restes Tyr C245 und das Nε-Atom von His B215 und die Hydroxylgruppe von Tyr C231 zum Cγ-Atom der Häm bD C-Ringpropionatgruppe. Entlang dieser gestrichelten Linie können einige polare und protonierbare Reste gefunden werden. Im Fall des „distalen Konformers“ von Glu C180 sind die Kohlenstoffatome hellblau dargestellt. Ansonsten ist die Farbkodierung wie für Abbildung 1B definiert. Die Gruppen, deren Rolle im „E-Weg“ experimentell unterstützt wird [1], Glu C180 und die Häm bD C-Ring Propionatgruppe, sind mit lila Ellipsoiden hervorgehoben. Die Elektronendichte, das eigentliche experimentelle Ergebnis, in das das atomare Modell eingepasst wird, ist in blau für ausgewählte Proteingruppen und in grün für Nicht-Proteingruppen wie die Hämgruppen und Wassermoleküle dargestellt.
(C) und (D) veranschaulichen die Konsequenzen der Abwesenheit des „E-Wegs” in dihämhaltigen Succinat:Menachinon-Reduktasen, z.B. von Gram-positiven Bakterien (C) bzw. dessen Anwesenheit in dihämhaltigen Menachinol:Fumarat-Reduktasen. Der „E-Weg“ in dihämhaltiger QFR. Das Periplasma befindet sich in den Abbildungen unten, das Cytoplasma oben;
(A), (B) Orthogonale Ansichten von mögl](https://www.mpg.de/365685/original-1293749693.jpg?t=eyJ3aWR0aCI6MzQxLCJmaWxlX2V4dGVuc2lvbiI6ImpwZyIsIm9ial9pZCI6MzY1Njg1fQ%3D%3D--e4f1cdb571d00f9fea0c321ddf0f7a4eeacdade9)