Ein wahrlich egoistisches Gen und seine Helfer
Forschungsbericht (importiert) 2013 - Max-Planck-Institut für Biophysik
Vererbung im Widerspruch zu mendelschen Regeln
Anfang des 20. Jahrhunderts fanden die Lehren von Gregor Mendel zur Vererbung von Merkmalen weite Verbreitung in der Wissenschaft. Eine der fundamentalen mendelschen Regeln besagt, dass unterschiedliche Allele (Genkopien) eines Merkmals mit gleicher Häufigkeit vererbt werden. In den 30er Jahren des vorigen Jahrhunderts machten amerikanische Forscher bei der Vererbung des Merkmals „Schwanzlänge“ von Mäusen aber eine Beobachtung, die dieser Regel widersprach. Sie entdeckten, dass das Merkmal „kurzer Schwanz“, das durch eine Genveränderung zustande kommt, von weiblichen Trägern zwar mit der erwarteten mendelschen Häufigkeit (50%) vererbt wurde. Männliche Träger hingegen zeugten doppelt so viele Nachkommen mit normaler Schwanzlänge wie Tiere mit kurzem Schwanz [1]. Fünf Jahrzehnte genetischer Forschung waren erforderlich, um ansatzweise zu verstehen, was diese ungewöhnlich hohe Vererbungsrate bewirkt.
Zunächst zeigte sich, dass das Merkmal „Schwanzlänge“ nicht ursächlich für die „Störung“ der mendelschen Vererbungsrate ist. Vielmehr liegt es nur genetisch in der gleichen Kopplungsgruppe und wird somit gemeinsam damit vererbt. Man fand zudem heraus, dass die bevorzugte Vererbung nicht durch ein einzelnes Gen, sondern durch einen größeren Abschnitt des Chromosoms 17 zustande kommt, in dem sich viele Gene befinden [2]. Männliche Tiere, die diesen veränderten Chromosomenabschnitt, den sogenannten t-Haplotyp, auf beiden Kopien des Chromosoms 17 tragen, sind steril [3]. Dies bedeutet zum einen, dass die bevorzugte Vererbung nur zustande kommt, wenn sowohl eine normale als auch eine veränderte Kopie dieses Chromosomenabschnitts vorhanden sind, zum anderen, dass die bevorzugte Vererbung mit der Befruchtung von Eizellen zu tun hat (Abb. 1).
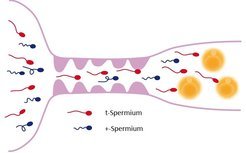 Bild vergrößern
Bild vergrößern
Aus mehreren Beobachtungen entstand die Idee, dass Spermatozoen, die den t-Haplotyp in sich tragen, „Superspermien“ sein könnten, also besser schwimmen und schneller zu den Eizellen gelangen könnten als Spermien mit einem normalen Chromosom. Ein Mischexperiment, bei dem gleiche Mengen von Spermien aus heterozygoten Männchen (t/+ Tiere, die ein normales Chromosom 17 und ein t-Haplotyp-Chromosom 17 tragen) mit Spermien aus normalen Männchen vermengt und für eine künstliche Befruchtung eingesetzt wurden, zeigte aber, dass dies nicht zutrifft. Die Spermien mit dem t-Haplotyp verloren nämlich ihren Vorteil bei der Befruchtung [4]. Sie waren also nicht erfolgreicher als Spermien von normalen Männchen. Vermutlich sind also die Spermien mit dem t-Haplotyp gegenüber den Spermien mit dem normalen Chromosom nur dann im Vorteil, wenn sie vom gleichen Tier stammen.
Einschränkung der Beweglichkeit benachteiligt Spermien mit unverändertem Chromosom 17
Wenn die Spermien mit dem t-Haplotyp gegenüber den Spermien mit dem normalem Chromosom aber nur dann im Vorteil sind, wenn sie vom gleichen Tier stammen, kann dies bedeuteten, dass die Spermien mit dem t-Haplotyp die andere Hälfte an Spermien mit dem normalen Chromosom bei der Befruchtung behindern und sich dadurch einen Vorteil verschaffen. Tatsächlich konnte man zeigen, dass Tiere, die sowohl einen t-Haplotyp als auch ein normales Chromosom in sich tragen, zwei Typen von Spermien erzeugen, die sich unterschiedlich bewegen. Ein Teil der Spermien verhält sich normal, ein anderer Teil schwimmt langsamer und weniger zielgerichtet. Da die Spermien mit dem t-Haplotyp bei der Befruchtung im Vorteil sind, zog man den Schluss, dass sie es sein müssten, die das normale Schwimmverhalten zeigen, während die schlechten Schwimmer diejenigen Spermien sein müssten, die das normale Chromosom 17 tragen [5].
Die Frage war nun, wie die Spermien mit dem normalen Chromosom durch die Spermien mit dem t-Haplotyp benachteiligt werden können. Durch aufwändige genetische Studien fand man heraus, dass im t-Haplotyp mindestens fünf veränderte Gene vorliegen, die zur bevorzugten Vererbung des t-Haplotyps beitragen. Diese Gene konnten in zwei Gruppen eingeteilt werden. Vier dieser Gene sind dafür zuständig, die Beweglichkeit der Spermien zu beeinträchtigen. Sie wirken kumulativ, jedes Gen trägt also zur Verstärkung des Effekts bei. Das fünfte Gen nimmt aber eine Sonderstellung ein, denn es wirkt als Schutz gegen die Beeinträchtigung der Spermienbeweglichkeit [2, 3].
Um den Mechanismus zu verstehen, wie daraus ein Vorteil für die Spermien erwächst, die den t-Haplotyp tragen, muss man wissen, dass Spermien in einem Zellverbund entstehen, in dem alle Zellen über Brücken miteinander verbunden sind, die den Austausch von Genprodukten erlauben (Abb. 2). Die Zellen mit dem t-Haplotyp produzieren Genprodukte von den vier veränderten Genen, die die Spermienbeweglichkeit beeinträchtigen. Diese werden auf alle Spermien verteilt. Dadurch würden also später beim Wettlauf zu den Eizellen alle Spermien gleichmäßig in ihrer Beweglichkeit beeinträchtigt. Keines der Spermien hätte einen Vorteil, wäre da nicht das fünfte Gen, das vor dieser Beeinträchtigung schützt. Dieses Gen wird erst nach der sogenannten zweiten Reifeteilung aktiv, wenn alle Spermienzellen, sich immer noch im Verbund befindend, nur noch je einen Chromosomensatz tragen. Dazu gehört in unserem Fall entweder das t-Haplotyp-Chromosom oder das normale Chromosom 17. Die Genprodukte des fünften Gens aber haben die ungewöhnliche Eigenschaft, dass sie in denjenigen Zellen verbleiben, in denen sie gebildet werden - sie werden nicht unter allen Zellen verteilt [6]. In diesem Verhalten äußert sich das egoistische Verhalten dieses Gens. Es ermöglicht, dass die normale Beweglichkeit nur in denjenigen Spermien wieder hergestellt wird, die den t-Haplotyp tragen, während die Spermien mit dem normalen Chromosom beeinträchtigt bleiben. Auf diese Weise erreichen die den t-Haplotyp tragenden Spermien die Eizellen schneller als die Spermien mit dem normalen Chromosom und verschaffen sich durch diesen Trick den entscheidenden Vorteil einer bevorzugten Vererbung. Wenn das nicht wahrlich egoistisch ist!
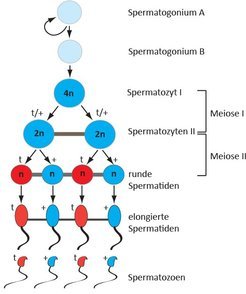 Bild vergrößern
Bild vergrößern
Abb. 2: Schematische Darstellung der Spermatogenese. Tiere, die ein t-Haplotyp- und ein normales Chromosom 17 tragen, produzieren zwei unterschiedliche Typen von Spermatozoen. Bei der Spermienbildung bleiben die Zellen nach der Zellteilung über zytoplasmatische Brücken miteinander verbunden und tauschen Genprodukte miteinander aus. Das t-Haplotyp-Chromosom 17 steuert die Bildung von Genprodukten, die die Schwimmfähigkeit der Spermatozoen beeinträchtigen (blau); diese werden auf alle Zellen verteilt. Nach der zweiten Reifeteilung (Meiose II) besitzen die Zellen (runde Spermatiden) nur noch einen Chromosomensatz (n). Vom t-Haplotyp-Chromosom wird nun ein Genprodukt (rot) hergestellt, das diese Beeinträchtigung ausgleichen kann und nur in den t-Spermien vorkommt. Nach der Freisetzung der fertigen Spermatozoen erlangen die t-Spermien so ihre normale Schwimmfähigkeit zurück, wohingegen die Spermatozoen mit dem normalen Chromosom 17 (+) schlechter schwimmen und den t-Spermien beim Wettlauf um die Befruchtung der Eizellen unterlegen sind.
Veränderte Proteinkinase (SMOKTCR) schützt t-Haplotyp-Spermien
Die molekularen Vorgänge bei diesem Phänomen wurden in der Abteilung Entwicklungsgenetik aufgeklärt. Die Wissenschaftler fanden heraus, dass es sich bei dem schützenden Gen um eine veränderte Proteinkinase (SMOKTCR) handelt, also um ein Protein, das Zielproteine phosphoryliert (Abb. 3) [7]. Sie ist Teil eines Signalwegs, der die Spermienbeweglichkeit kontrolliert. Im Signalweg oberhalb dieser Kinase stehen G-Proteine der RHO-Unterfamilie, die für ihre Bedeutung bei der Kontrolle der Zellbewegung beispielsweise von Leukozyten oder Krebszellen bekannt sind. Diese RHO-Proteine wiederum werden von Produkten der vier Gene reguliert, die auf dem t-Haplotyp liegen und die Spermienbeweglichkeit beeinträchtigen [8 - 10]. Die vier Regulatoren verändern die Aktivität der RHO-Proteine derart, dass sie die normale Form der besagten Proteinkinase (SMOK) zu überhöhter Aktivität anregen. Diese gibt das „übersteuerte“ Signal an den Bewegungsapparat der Spermien weiter, wodurch deren Schwimmfähigkeit beeinträchtigt wird. In Spermien, die den t-Haplotyp tragen, ermöglicht die veränderte Proteinkinase SMOKTCRan dieser Stelle aber eine Hemmung der Signalweiterleitung. Die Hemmung erfolgt in genau dem Maß, dass die normale Beweglichkeit der Spermienzellen wieder herstellt wird. Dieses fein ausgeklügelte System ermöglicht letztendlich die bevorzugte Vererbung des t-Haplotyps [7 – 10].
 Bild vergrößern
Bild vergrößern
Gezielte Übertragung der Erkenntnisse auf die Nutztierzucht
Vermutlich hat es Dutzende Genveränderungen erfordert und mehr als eine Million Jahre gedauert, bis dieses Phänomen in der Evolution entstehen konnte. Um das Phänomen als Abweichung von der Regel zu verstehen, mussten außerdem zuerst die Gesetze der Vererbung von Mendel erkannt werden. Etwa sieben Jahrzehnte genetischer und molekularbiologischer Forschung waren dann erforderlich, um weitgehend aufzuklären, wie dieses Phänomen molekular zustande kommt.
Was kann man nun mit diesen Erkenntnissen anfangen? Neben dem Erkenntnisgewinn erschließt sich auch eine Möglichkeit der Anwendung, die am Max-Planck-Institut für molekulare Genetik weiterverfolgt wird. Die Forscher arbeiten daran, die Erkenntnisse gezielt einzusetzen, um die Vererbung von Merkmalen bei Nutztieren zu steuern. Ein wirtschaftlich wichtiges Merkmal von Nutztieren ist ihr Geschlecht. Bei Milchrindern zum Beispiel werden nur wenige Zuchtbullen, aber viele Kühe für die Milchproduktion benötigt. Bei Fleischrassen dagegen bevorzugt der Züchter junge Bullen für die Mast, da sie viel mehr Muskelmasse ansetzen als die weiblichen Rinder. Bei vielen anderen Nutztieren gibt es eine Geschlechtspräferenz, wobei meistens die weiblichen Nachkommen bevorzugt werden. Geboren werden bei allen Arten naturgemäß aber je zur Hälfte männliche und weibliche Tiere. Als Folge werden jedes Jahr Millionen unerwünschter Jungtiere getötet, weil sich deren Aufzucht wirtschaftlich nicht auszahlt. Eine gezielte Veränderung der Vererbungsrate des Geschlechts von Nutztieren wäre daher sowohl aus wirtschaftlichen Gründen als auch im Interesse des Tierschutzes als ein großer Fortschritt anzusehen. Angesichts der noch ansteigenden Weltbevölkerung könnte dies zudem einen bedeutenden Beitrag zur Ernährung der Menschheit leisten.