ATP-Synthasen
< zurück zu den anderen Projekten
Membranproteine und Membranproteinkomplexe sind für cryoEM eine größere Herausforderung als lösliche Komplexe, teilweise weil sie weniger starr sind, aber auch weil sie weniger stabil und schwieriger herzustellen sind. Mitochondriale ATP-Synthasen sind seit langem ein Forschungsinteresse in der Abteilung. ATP-Synthasen produzieren durch Rotationskatalyse praktisch das gesamte ATP in der Zelle. Ein Transmembran-Protonengradient treibt einen Rotor in der Membran an, der die ATP-Erzeugung antreibt. Der genaue Mechanismus, durch den dies geschieht, ist noch nicht bekannt. Wir haben bedeutende Fortschritte bei der vollständigen Aufklärung dieses streng konservierten Prozesses erzielt, der einer der grundlegendsten und ältesten in der Biologie ist.
Alle Arten von rotierenden ATPasen entsprechen im Wesentlichen dem gleichen Bauplan. ATPasen vom F-Typ bestehen aus einem ungefähr kugelförmigen, wasserlöslichen F1-Kopf und dem Fo-Subkomplex in der Membran. Der F1-Kopf enthält drei katalytische β- und drei nicht katalytische α-Untereinheiten, die sich in einem hexameren (αβ)3-Ring abwechseln. Der Fo-Subkomplex besteht aus dem C-Ring-Rotor, den Statoruntereinheiten a und b und in Mitochondrien einer Reihe anderer kleiner hydrophober Untereinheiten. ATPasen vom V-Typ und A-Typ haben entsprechend einen globulären V1(A1) -Katalysekopf und einen Vo (Ao) -Unterkomplex mit einem Rotorring in der Membran. Bei allen rotierenden ATPasen verbindet der zentrale Stiel den katalytischen Kopf mit dem Rotorring. Die Rotorringe von ATP-Synthasen vom F-Typ haben 8 bis 15 c-Untereinheiten (Abbildung 2). Die meisten c-Untereinheiten sind Haarnadeln von zwei hydrophoben Transmembranhelices, während die Ringuntereinheiten von ATPasen vom V- und A-Typ häufig zwei oder mehr Transmembranhelix-Haarnadeln aufweisen. Zusätzlich zum zentralen Stiel haben ATPasen vom F-Typ einen peripheren Stiel, der den katalytischen Kopf mit dem Stator in der Membran verbindet, um eine Leerlaufdrehung der gesamten Anordnung zu verhindern. Die ATPasen vom A-Typ haben zwei periphere Stiele und die ATPasen vom V-Typ drei.
(a) Mitochondriale ATP-Synthase aus Polytomella (Werner Kühlbrandt)
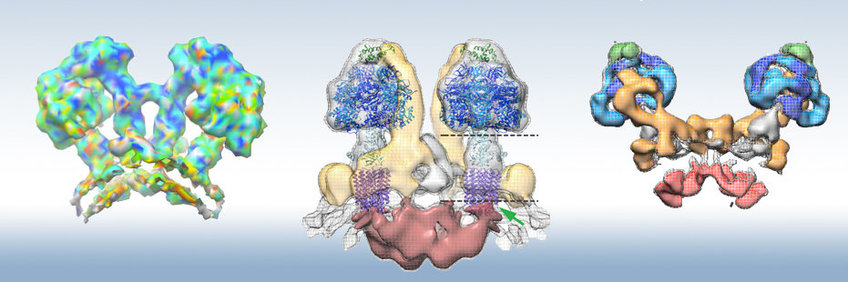
Wir haben die Struktur des 1,6-MDa-ATP-Synthase-Dimers aus Mitochondrien der chlorophylllosen Grünalge Polytomella sp. durch Single-Particle-KryoEM bei einer Auflösung von 2,7 Å. Das Polytomella-Dimer ist steifer als das von Hefen (siehe unten) oder Säugetieren und eignet sich besser für hochauflösendes KryoEM. Die Struktur zeigt die Anordnung der beiden katalytischen F1-Köpfe, der zentralen und peripheren Stiele und eines Paares von Rotorringen im Dimerkomplex. Wir entdeckten, dass die a-Untereinheit ein Bündel von vier langen membran-intrinsischen α-Helices im rechten Winkel zum C-Ring-Rotor bildet. Die langen horizontalen Helices erzeugen ein Paar von Protonenhalbkanälen an der A / C-Grenzfläche, die die Protonierung der Glutamate der c-Untereinheit von der Lumenseite und die Protonenfreisetzung in die Matrix ermöglichen und die C-Ring-Rotation und ATP-Synthese vorantreiben (Allegretti et al ., Nature 2015). Seit unserer Entdeckung hat sich die lange, quasi-horizontale Helix-Haarnadel der a-Untereinheit neben dem C-Ring-Rotor und den beiden Halbkanälen als grundlegendes, hochkonserviertes Merkmal aller rotierenden ATPasen erwiesen (Kühlbrandt und Davies, TIBS 2016).
(b) Mitochondriale ATP-Synthase aus Yarrowia lipolytica (Werner Kühlbrandt, Thomas Meier)
ATP-Synthase-Dimere aus Hefen ähneln denen aus Säugetier-Mitochondrien, unterscheiden sich jedoch hinsichtlich Struktur und Zusammensetzung der Untereinheiten von denen von Pflanzen und Grünalgen. Um einen Einblick in diese häufigere und medizinisch relevantere ATP-Synthase zu erhalten, führten wir Single-Particle-KryoEM an Dimeren aus der aeroben Hefe Y. lipolytica durch, die für hochauflösendes KryoEM besser geeignet waren als der Rinderkomplex. Das Y. lipolytica-Dimer ist eine Anordnung von 17 verschiedenen Polypeptiden in 62 einzelnen Proteinuntereinheiten. Die KryoEM-Map mit einer Auflösung von 6,2 Å zeigt eine scharfe Biegung der Mizelle um ~ 90 °, die den Fo-Teil umgibt, was die hohe lokale Krümmung an den Rippen der inneren Membrankristalle widerspiegelt (Hahn et al., Mol Cell 2016). In der Membranregion des Komplexes haben wir sieben verschiedene Membranuntereinheiten aufgelöst und identifiziert, einschließlich der dimerspezifischen Untereinheiten e und g, von denen wir zuvor gezeigt haben, dass sie für die Stabilität des Dimers und die Bildung von Kristallen wesentlich sind (Davies et al., PNAS 2012).
(c) Elektronenkryotomographie mitochondrialer ATP-Synthasen in situ (Werner Kühlbrandt)
Im Gegensatz zur bakteriellen und Chloroplasten-ATP-Synthase oder den ATPasen vom V- und A-Typ bilden alle bekannten mitochondrialen ATP-Synthasen Dimere in der Membran. wie wir durch KryoET intakter Mitochondrien oder Cristae-Vesikel entdeckt haben (Strauss et al., EMBO J 2008; Davies et al., PNAS 2011; Daum et al., PNAS 2013). Die Dimere sind in langen Reihen entlang der eng gekrümmten Grate der mitochondrialen inneren Membrankristalle angeordnet. Die Dimerreihen haben einen tiefgreifenden Einfluss auf die Atmungsaktivität, die Wachstumsraten und die mitochondriale Morphologie. Die Reihen sind maßgeblich für die Bildung der inneren Membrankristalle, die die für Atmungskettenkomplexe verfügbare Membranfläche vergrößern. Das Cristae-Lumen kann als mitochondriales Unterkompartiment betrachtet werden, das die ATP-Produktion durch lokale Variationen der Protonenkonzentration unterstützen kann.
Cristae-Vesikel aus Protozoen-Mitochondrien unterscheiden sich häufig stark von der Standardmorphologie. Die Mittelung des Subtomogramms ergab, dass die Dimere selbst sehr unterschiedlich sein können, insbesondere in Bezug auf den Winkel der zentralen Stalks, der bei Pilzen und Säugetieren ~ 90 ° beträgt, jedoch zwischen etwa 60 ° (Trypanosomen, Polytomellen) und 0 ° (Paramecium) liegt. Bei Paramecium, wo sich U-förmige ATP-Synthase-Dimere zu regelmäßigen helikalen Anordnungen zusammensetzen, die den für diese und ähnliche Arten charakteristischen röhrenförmigen Kristallen eine helikale Struktur und damit eine Membrankrümmung auferlegen, sind Unterschiede auffällig. Bemerkenswerterweise induzieren die Dimerreihen eine hohe, gleichmäßige Membrankrümmung, obwohl der Dimerwinkel 0 ° beträgt und daher ein einzelnes Dimer die Membran nicht biegt (Mühleip et al., PNAS 2016b). Noch auffälliger sind die Unterschiede bei Trypanosomen und Euglena, wo die Struktur des F1-Subkomplexes, von der angenommen wurde, dass sie in allen ATPasen vom F-Typ universell konserviert ist, von der Konsensstruktur abweicht. Wir entdeckten, dass bei der Euglenacea, zu der gefährliche menschliche Parasiten gehören, die α- und β-Untereinheiten eher eine trigonale Pyramide bilden als das übliche fast sechsfache Fass. Diese ungewöhnliche Architektur beruht auf einer Aufspaltung der α-Untereinheit in separate N- und C-terminale Domänen, wodurch die katalytische Stelle der ATP-Produktion im F1-Kopf gestört wird. Die einzigartige Struktur dieser ATP-Synthasen, von deren Überleben die Organismen abhängen, eröffnet einen neuen Weg für die Arzneimittelentwicklung zur Bekämpfung der durch Trypanosomen verursachten Schlafkrankheit (Mühleip et al., PNAS 2016a).


