Membrantransporter, -kanäle, und -enzyme
< zurück zu den anderen Projekten
Die erste Struktur eines sekundäraktiven Transporters, des E. coli-Natrium / Protonen-Antiporters NhaA, wurde in dieser Abteilung durch Elektronenkristallographie mit einer Auflösung von 6 Å bestimmt (Williams, Nature 2000; Williams et al., EMBO J 1999). Seitdem wurden von uns und anderen zahlreiche Röntgenstrukturen von sekundäraktiven Transportern veröffentlicht. Mit den jüngsten Entwicklungen sind sogar vergleichsweise kleine Membrantransporter und Ionenkanäle in Reichweite von Einzelpartikel-KryoEM.
Kristallographie von Natriumprotonen-Antiportern
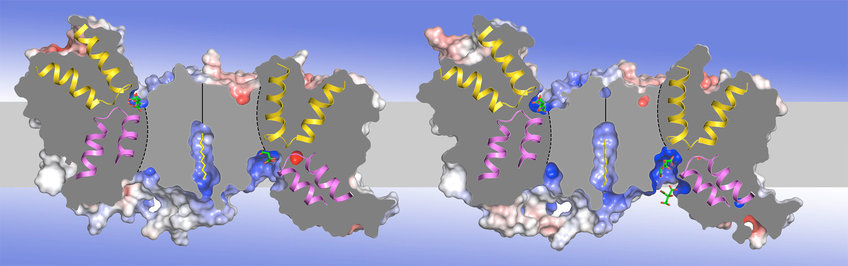
Der elektroneutrale Na + / H + -Antiporter NhaP aus dem hyperthermophilen Archäon Pyrococcus abyssi (PaNhaP) ist ein funktionelles Homolog des medizinisch wichtigen menschlichen Antiporters NHE1. Wir haben die Struktur von PaNhaP durch Röntgenkristallographie bei pH 8 (Abbildung 1A) und pH 4 bestimmt. Das Substration wurde zum ersten Mal in einem solchen Transporter durch Einweichen von Kristallen mit Thallium, einem anomalen Röntgenstreuer, der Na+ nachahmt, aufgelöst in der Bindungsstelle (1B). Transportmessungen zeigen, dass Thallium ein Substrat für PaNhaP ist. Das Substration wird von drei sauren Seitenketten, einem Wassermolekül, einem Serin und einem Carbonyl der Hauptkette im abgewickelten Abschnitt der TM-Helix 5 koordiniert (Wöhlert et al., ELife 2014).
Wir haben auch die Struktur des verwandten Na + / H + -Antiporters NhaP1 aus Methanococcus jannaschii (MjNhaP1) in zwei komplementären Zuständen bestimmt. Die 3,5 Å-Röntgenstruktur des nach innen offenen Zustands in Gegenwart von Natrium bei pH 8, wo der Transporter hoch aktiv ist, wurde durch molekularen Ersatz durch PaNhaP gelöst. Die 6 Å-Struktur des komplementären nach außen offenen Zustands wurde durch Elektronenkristallographie von 2D-Kristallen bei pH 4 erhalten, bei denen der Transporter inaktiv ist (Paulino et al., ELife 2014). Ein Vergleich ergab eine Neigung des 6-Helix-Bündels um 7 °, das die Ionenbindungsstelle enthält. Progressive substratinduzierte Konformationsänderungen in MjNhaP1 wurden durch Differenzkarten untersucht, die aus 2D-Kristallen erhalten wurden, die mit einer Reihe von physiologischen pH- und Na+ -Bedingungen inkubiert wurden (Paulino und Kühlbrandt, eLife 2014). Änderungen der Na+ -Konzentration verursachten eine deutliche Konformationsänderung, die weitgehend pH-unabhängig war, was mit der Substratkonkurrenz um eine gemeinsame Ionenbindungsstelle übereinstimmt, wie elektrophysiologische Studien in Zusammenarbeit mit Klaus Fendler in der Abteilung Bamberg (Calinescu et al., J. Biol. Chem 2014). Projektionsdifferenzkarten zeigten Helixbewegungen an, die MjNhaP1 vom protonengebundenen, nach außen offenen Zustand in den Na+ -gebundenen, nach innen offenen Zustand umwandeln. Die Oszillation zwischen den beiden Zuständen führt zu einem schnellen Antiport.
Der Citrattransporter SeCitS
Wir haben die Röntgenstruktur des Natrium / Citrat-Symporters SeCitS aus dem humanpathogenen Erreger Salmonella enterica gelöst, der Citrat als Nährstoff aufnimmt. Unerwarteterweise stellten wir fest, dass die Struktur der bakteriellen Citrattransporter der der Natrium / Protonen-Antiporter ohne nachweisbare Sequenzhomologie sehr ähnlich ist. Die Röntgenstruktur mit einer Auflösung von 2,5 Å von SeCitS enthält zwei Dimere. In jedem Dimer nehmen die beiden Protomere unterschiedliche Konformationen von innen nach außen oder von außen nach außen an, die nicht aus Kristallkontakten resultieren. Die Struktur zeigt somit drei Funktionszustände des aktiven Protomers in einer asymmetrischen Einheit (Abbildung 1C-E), was beispiellos ist. Zusammen mit umfassenden Funktionsstudien von in Liposomen rekonstituiertem SeCitS erklären die Strukturen den Transportmechanismus als sechsstufigen Prozess mit einer Starrkörper 31°-Rotation eines Helixbündels um eine Achse in der Membranebene senkrecht zur langen Dimerachse. Die Rotation des Helixbündels verschiebt die gebundenen Substrate vertikal um 16 Å über die Membran. Wir erwarten, dass ähnliche Transportmechanismen für eine Vielzahl von Sekundärtransportern gelten (Wöhlert et al., ELife 2015).
Abbildung 1. Röntgenstrukturen sekundäraktiver Transporter
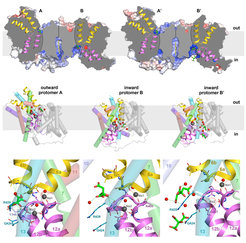
(A) Struktur des elektroneutralen Na+ / H+ -Antiporters PaNhaP von P. abyssi. (B) Substrationenkoordination im archaealen Natrium / Protonen-Antiporter PaNhaP. Die sauren Seitenketten von Glu73, Asp159, einem von Asp130 gehaltenen Wassermolekül, die Hydroxylgruppe von Ser155 und das Carbonyl der Hauptkette von Thr129 koordinieren das Substration (graue Kugel). Die anomale Dichte für das Tl+ -Ion an der Substratbindungsstelle zwischen der Helix H3, H6 und der abgewickelten Strecke von H5 ist in Magenta bei 4σ gezeigt. Rote Kugeln sind Wassermoleküle. Aus (Wöhlert et al., ELife 2014). (C) Die zwei verschiedenen Dimere des Citrattransporters SeCitS von S. enterica in der asymmetrischen Einheit. (D) Nach innen offene und nach außen offene Protomere im asymmetrischen SeCitS-Dimer. (E) Details der Substratbindungsstelle. Im nach außen gerichteten Protomer (links) wird Citrat durch Seitenketten von zwei Helix-Haarnadeln und Helix H13 eng koordiniert. In dem nach innen gerichteten Protomer B (Mitte) wird Citrat hydratisiert und schwach an die glycinreiche Schleife der Helix H12 gebunden. In Protomer B' (rechts) ist nur die Na1-Stelle besetzt. Zwei Citratmoleküle werden aufgelöst, was einen wahrscheinlichen Verlauf für die Citratfreisetzung darstellt. Aus (Wöhlert et al., ELife 2015).
KryoEM von Transportern und Ionenkanälen
Der humane TRP-Kanal Polycystin-2 (PC2) reagiert auf Änderungen der cytosolischen Calciumkonzentration. PC2-Mutationen lösen eine autosomal dominante polyzystische Nierenerkrankung aus. PC2 findet sich überwiegend im endoplasmatischen Retikulum (ER), im primären Cilium und je nach Zelltyp in der Plasmamembran. Wir haben KryoEM-Strukturen von zwei PC2-Kanälen voller Länge aus der Plasmamembran oder dem endoplasmatischen Retikulum mit einer Auflösung von 4,2 Å bestimmt (Abbildung 2). Die Strukturen zeigen zwei unterschiedliche offene Zustände im Komplex mit Lipiden und Ca2+. Ein einzelnes Ca2+ wird im Selektivitätsfilter gebunden, während mehrere Ca2+ -Ionen entlang des Translokationsweges einen elektrostatischen Abschlagmechanismus zur Erhöhung der Ca2+ -Selektivität außerhalb des ER nahe legen (Wilkes et al., NSMB 2016).
PilQ, ein bakterielles Proteinexport- / DNA-Aufnahmesystem
Bakterien verwenden Flagellen oder Pili zur Fortbewegung. Während Flagellenmotoren gut charakterisiert sind, ist viel weniger über die Maschinerie bekannt, die bakterielle Pili erzeugt. Der Typ 4-Pilus (T4P) -Sekretionskomplex von Thermus thermophilus ist eine 1100 kDa-Anordnung mehrerer verschiedener Membran- und Membran-assoziierter Proteine. Der T4P-Komplex ist sowohl bei der Extrusion von Pili als auch bei der Aufnahme von DNA während der bakteriellen Transformation aktiv. In Zusammenarbeit mit Beate Averhoff (Universität Frankfurt) bestimmen wir die Struktur des T4P-Komplexes mit cryoEM. Subtomogramm-Mittelwerte von T4P in ganzen Thermus thermophilus-Zellen zeigen den Komplex im geschlossenen und offenen Zustand, wobei ein Pilus gerade extrudiert wird (Gold et al., ELife 2015).

