Bakterielle porenbildende Toxine
< zurück zu den anderen Projekten
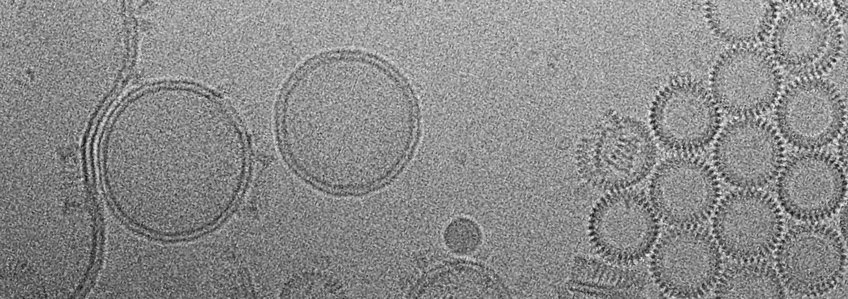
Grampositive Pathogene wie Pneumococcus, Listeria und Clostridium sezernieren cholesterinabhängige Cytolysine (CDCs) als lösliche Monomere. Die Monomere binden an cholesterinhaltige Zielmembranen, wo sie sich zu großen, kreisförmigen Poren zusammensetzen, die die Zielzellen perforieren. Die Struktur und der Mechanismus porenbildender Toxine werden in der Projektgruppe von Dr. Özkan Yildiz in der Abteilung untersucht, der die Röntgenstruktur von zwei CDCs in löslicher Form bestimmte: Listeriolysin (LLO) aus Listeria monocytogenes (Köster et al ., Nat Comm 2014) und Pneumolysin (PLY) aus Streptococcus pneumoniae (van Pee et al., Nano Letters 2016). Um den Mechanismus der Porenbildung und der Membranperforation im Detail zu verstehen (Video 1), haben wir die Struktur des ~ 2,2-MDa-Porenkomplexes von PLY durch Single-Particle-KryoEM bei einer Auflösung von 4,5 Å bestimmt (Abbildung 1). Der PLY-Porenkomplex ist ein 400-Å-Ring aus 42 Membran-inserierten Monomeren. Während der Membraninsertion faltet sich eine der vier Proteindomänen im löslichen Monomer in zwei ~85Å β-Haarnadeln um, die die Lipiddoppelschicht durchqueren. In der Membran bilden die Haarnadeln einen zylindrischen 168-strängigen β-Zylinder (Abbildung 1A, B). Große Seitenketten werden auf der unpolaren äußeren Zylinderoberfläche aufgelöst, während die innere Laufoberfläche stark geladen ist (Abbildung 1B). CryoET zeigt, dass sich die löslichen Monomere auf cholesterinhaltigen Liposomen zu kreisförmigen Präporen mit mehreren Untereinheiten zusammensetzen, wobei Reste der Membranoberfläche Lipidspezifität verleihen. Tomographische Volumina zeigen, dass die Lipiddoppelschicht in der Präpore intakt ist (1C, D), während sie in der reifen Pore verschwunden ist (1E, F). Vermutlich stößt die hochgeladene innere Porenoberfläche ab und hilft, in der Pore eingeschlossenes Lipid zu dispergieren (van Pee et al., ELife 2017).
