Wie das HIV-Kapsid den Schutzwall des menschlichen Zellkerns knackt
Neue Erkenntnisse deuten auf einen destruktiven Eintritt des HIV-1-Kapsids in den Zellkern menschlicher Zellen hin
Forschende des Max-Planck-Instituts für Biophysik und der Universität Heidelberg haben weitgehend intakte HIV-1-Kapside beobachtet, die durch spezielle Kanäle, die so genannten Kernporen, in den Zellkern gelangen. In einer spannenden interdisziplinären Studie schlagen die Wissenschaftler*innen einen neuen Mechanismus vor, der die genetische Information des Virus innerhalb des Kapsids auf Kosten der Integrität der Kernpore schützt.
Text: Pamela Ornelas/Stefanie Boehm
Kurz und bündig: Ein Forscherteam des Max-Planck-Instituts für Biophysik und der Universität Heidelberg unter der Leitung von Martin Beck, Gerhard Hummer und Hans-Georg Kräusslich hat einen neuartigen Mechanismus entdeckt, durch den das HIV-1-Kapsid in den Kern einer menschlichen Zelle gelangt. Sie präsentieren überraschende neue Beweise dafür, dass das Kapsid den Kanal, den es für den Eintritt in den Zellkern benutzt, den Kernporenkomplex, aufbricht, während es selbst intakt bleibt. Ihre interdisziplinäre Studie, die in der Fachzeitschrift Cell veröffentlicht wurde, zeigt, dass das Kapsid beim Eintritt in den Zellkern seine strukturelle Stabilität beibehält und kann damit die zukünftige Entwicklung von HIV-1 Inhibitoren beeinflussen.
Das humane Immundefizienz-Virus Typ 1 (HIV-1) greift wichtige Zellen unseres Immunsystems an und macht infizierte Personen anfälliger für andere Infektionen. Sobald HIV-1 in menschliche Zellen eingedrungen ist, transportiert es seine Erbinformation in den Kern der Zelle, wo diese in das virale Genom der menschlichen Wirtszelle integriert wird. Da die virale Erbinformation dann nicht mehr entfernt werden kann, lässt sich die HIV-1 Infektion nicht heilen. Anschließend nutzt das Virus die Maschinerie unseres Körpers, um Kopien von sich selbst herzustellen und die Infektion zu verbreiten.
In den letzten Jahrzehnten haben das Verständnis und die Behandlung der HIV-Infektion enorme Fortschritte gemacht. Das neue Medikament Lenacapavir, das an das virale Kapsid bindet und Kernimport und Freisetzung des viralen Genoms blockiert, konnte in klinischen Studien die Infektion durch HIV-1 vollständig verhindern. Vor kurzem erhielt es daher von der amerikanischen Food and Drug Administration den Status eines Therapiedurchbruchs und wurde von der Fachzeitschrift Science als Durchbruch des Jahres ausgezeichnet.
Lenacapavir kann also gegen eine Infektion vorbeugen und die Ausbreitung des Virus verhindern. Es kann jedoch die Integration der genetischen Information des Virus in das menschliche Genom nicht rückgängig machen und bietet daher keine „Heilung“. Die Aufdeckung weiterer Details zum Mechanismus der Inhibition kann dazu beitragen die Elimination des Virus zu ermöglichen.
Entscheidend für die Vorgänge bis zur Freisetzung des Genoms ist die Proteinhülle von HIV-1, das Kapsid. Es ist, ähnlich wie ein Fußball, aus Hexameren und Pentameren aufgebaut. Es ist jedoch nicht kugelförmig, sondern hat die Form eines Kegels mit einem schmalen und einem breiteren Ende. Dieses Kapsid enthält die virale Nutzlast, das Genom, und schützt sie gegen Abwehrmechanismen der Zelle. Für eine erfolgreiche Infektion muss es sich aber schließlich öffnen und die virale Erbinformation in den Kern der Wirtszelle entlassen. In ihrer neuen Arbeit haben die Forschungsgruppen von Martin Beck und Gerhard Hummer vom Max-Planck-Institut für Biophysik in Frankfurt und Hans-Georg Kräusslich von der Universität Heidelberg hochauflösende Bildgebung mit aufwendigen Computersimulationen kombiniert, um den Eintritt von HIV-1-Kapsiden in infizierte menschliche Immunzellen, sogenannte Makrophagen, zu untersuchen.
Wie gelangen die Kapsiden durch einen Kanal von ähnlicher Breite?
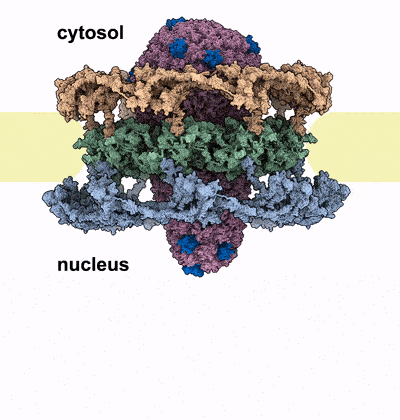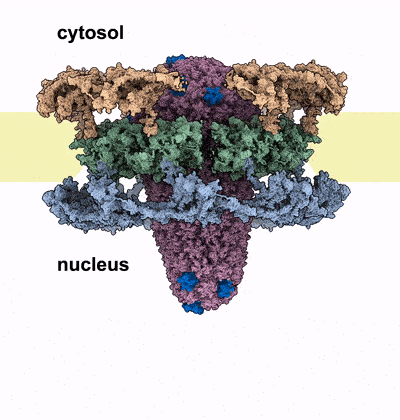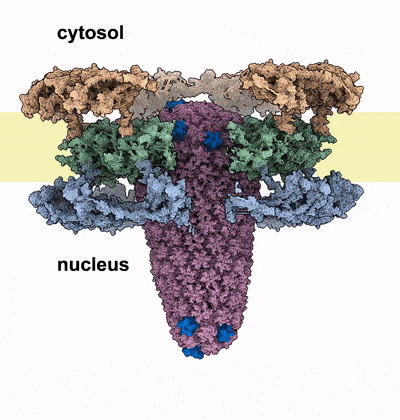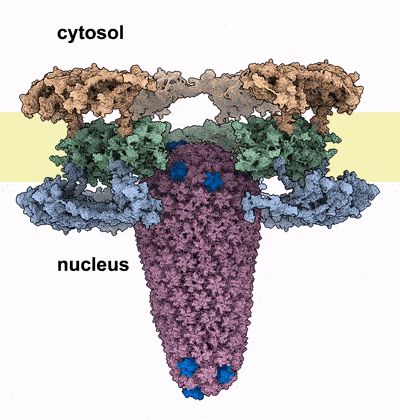
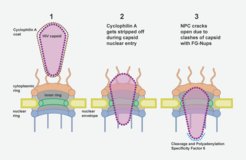
Kernporen sind die Wächter des menschlichen Genoms, das im Zellkern aller Zellen verpackt ist. Sie bilden selektive Kanäle durch die Hülle des Zellkerns und verbinden dessen Inneres mit dem Zytoplasma. Diese Kanäle sind mit spezialisierten Proteinen, den FG-Nukleoporinen, gefüllt, die als Türsteher an der Eingangstür fungieren. Sie kontrollieren, welche Moleküle in den Kanal eindringen können und welche außerhalb des Zellkerns bleiben müssen. Der Eindringling muss diese Barriere passieren, um seine Nutzlast in den Zellkern zu bringen. Das HIV-1 Kapsid erreicht dies, indem es die Eigenschaften von menschlichen Proteinen nachahmt, die die Kernpore passieren können. Die Autor*innen heben jedoch hervor, dass das Kapsid an seiner breitesten Stelle eine ähnliche Größe wie der Durchmesser des Kernporen-Kanals hat. Diese Tatsache unterstützte Hypothesen, dass sich die Kapside vor Eintritt in den Zellkern auflösen und das genetische Material des Virus freisetzen. Die neuen Erkenntnisse von Kreysing, Heidari, Zila et al, die in der Fachzeitschrift Cell veröffentlicht wurden, zeigen nunmehr, dass das Kapsid den Zellkern weitgehend intakt erreicht, dabei aber die Kernpore massiv verändert.
Mit Hilfe modernster hochauflösender Mikroskopie und zellulärer Tomographie konnten die Autor*innen HIV-1 Kapside in verschiedenen Bereichen infizierter menschlicher Makrophagen beobachten. Sie stellten fest, dass die Kapside mit ihren schmalen Enden zuerst in den Kernporenkanal eingedrungen waren und sich dann immer weiter dem Kern genähert hatten. Anders als erwartet, zeigten die Kapside im Kernporenkanal keine Anzeichen von Verformung oder Zerbrechen. Stattdessen entdeckten die Forscher eine beträchtliche Anzahl von Kernporen, die aufgesprungen waren, sobald das breite Ende des Kegels tief in den Kanal eingedrungen war und sich dem Kern genähert hatte. Die Autor*innen vermuten, dass der Eintritt des Kapsids in die Kernpore eine Kraft erzeugt, die den Durchmesser des Kanals vergrößert, bis die ringförmige Struktur aufbricht, ähnlich wie ein Nagel, der seine umgebende Struktur zerbricht, sobald er vorwärts getrieben wird. Durch diesen Riss weitet sich der Kanal und das Kapsid kann in den Zellkern vordringen. Computersimulationen des Prozesses stützen diese Hypothese: Das Kapsid konnte die Kernpore in diesen Modellen nur passieren, wenn der Ringdurchmesser vergrößert oder wenn der Ring aufgebrochen wurde.
Auf dem Weg zu einem besseren Verständnis von HIV-1
Die Forschenden schlagen basierend auf ihren Entdeckungen definierte Schritte vor, wie das HIV-1 Kapsid in den Zellkern gelangt. Sie vermuten, dass die besondere Kegelform des Kapsids nötig ist, um in die Kernpore einzutreten, diese zu durchdringen und das virale Genom in den Kern der infizierten Zelle zu schleusen.
Jan Philipp Kreysing, einer der gemeinsamen Erstautoren sagt, dass die Ergebnisse nicht nur die molekularen Details eines kritischen Schritts während der HIV-1 Infektion aufklären, sondern auch völlig neue Erkenntnisse über Kernporen als zentralen Transportweg zwischen Zytoplasma und Zellkern liefern. Darüber hinaus helfen die Ergebnisse, den Wirkmechanismus des zugelassenen Medikaments Lenacapavir zu erklären, das an das Kapsid bindet und Kernimport und Freisetzung des Virusgenoms verhindert, ergänzt Hans-Georg Kräusslich. Dies ist ein gutes Beispiel, wie wichtig Grundlagenforschung für die Medikamentenentwicklung sein kann. Ein Kapsid, das die Kernpore aufbrechen kann, könnte dem Virus die Übertragung einer größeren Nutzlast ermöglichen und so einen entscheidenden Vorteil verschaffen. Letztlich muss sich das Kapsid jedoch im Kern öffnen, um das virale Genom freizusetzen, und weitere Untersuchungen müssen klären, wie dies geschieht. Die Frage, wie HIV mit infizierten menschlichen Zellen interagiert, bleibt also ein aktives Forschungsgebiet.













