Den Funktionsmechanismen eines ABC-Transporters auf der Spur
Zwei Konformationszustände des mitochondrialen ABC-Transporters Atm1 aus Hefe während seines Transportzyklus
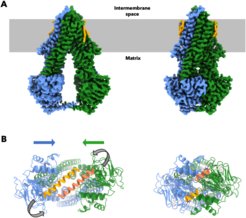
Der ABC-Transporter Atm1 exportiert ein bisher unbekanntes Molekül in das Zytosol von Hefen, das der Biogenese von zytosolischen Eisen-Schwefel-Proteinen, der zellulären Eisenregulation und der Modifikation von tRNAs mit Schwefelatomen dient. Die 3D-Strukturen zweier komplementärer Zustände von Atm1 konnten durch Kryo-Elektronenmikroskopie (Kryo-EM) mit Auflösungen von 2,9 bzw. 3,3 Å bestimmt werden.
Die Superfamilie der ABC-Transporter ist eine der umfangreichsten bekannten Proteinfamilien, deren Mitglieder in allen Reichen des Lebens vorkommen. ABC-Transporter sind Membranproteine, die als gemeinsames Strukturelement eine ATP-bindende Kassette (ABC) enthalten und an aktiven Transportprozessen durch Zellmembranen beteiligt sind. Die Energie für den Substrattransport wird durch Hydrolyse von Adenosintriphosphat (ATP) an den Nukleotid-bindenden Domänen (NBDs), die die ABCs formen, bereitgestellt.
Ein Team aus Wissenschaftlern der Philipps-Universität Marburg und des Max-Planck-Instituts für Biophysik in Frankfurt am Main hat einen ABC-Transporter der Hefe, Atm1, mittels Kryo-EM in einer Nanodisk-Umgebung, die die natürliche Lipiddoppelmembran nachahmt, genauer untersucht. "Wir fanden heraus, dass der nach innen geöffnete Zustand der Kristallstruktur von nukleotidfreiem apo-Atm1 sehr ähnlich ist. Die geschlossene Konformation mit dem gebundenen ATP-Analogon AMP-PNP zeigt eine enge Assoziation beider NBDs, eine Umstrukturierung der C-terminalen Helices und die Gestalt eines abgeschlossenen Hohlraums im homodimeren Transporter zur mutmaßlichen Substratbindung. Wir konnten außerdem eine hydrophobe Region an den C-terminalen Helices identifizieren, die unter den strukturell erforschten ABC-Transportern vom Typ IV einzigartig ist", sagt Thomas Ellinghaus vom Max-Planck-Institut für Biophysik.
Dadurch wurden neue Einblicke in die Stabilisierung des Dimers Atm1 durch beide C-terminalen Helices und in die relative Bewegung beider Helices während des Transportzyklus möglich. Die hierbei identifizierten Interaktionen der C-terminalen Helices sind spezifisch für den jeweiligen Zustand. Gekappte Mutanten des Hefeproteins deuten außerdem darauf hin, dass die C-terminalen Helices das Dimer stabilisieren, jedoch nicht für die Assoziation der NBDs erforderlich sind, was im Einklang mit in vivo-Daten der Gruppe von Roland Lill an der Universität Marburg steht.
ABC-Transporter haben generell eine große medizinische, industrielle und wirtschaftliche Bedeutung erlangt, da sie z. B. bei der Multiresistenz pathogener Bakterien und in der Pharmakokinetik von Krebstherapeutika eine wichtige Rolle spielen. Darüber hinaus sind Genmutationen, die zur Reifung nicht funktionsfähiger ABC-Transporter führen können, die Ursache für verschiedene Stoffwechselerkrankungen. Eine bekannte Erbkrankheit, die auf Defekte von ABCB7, dem menschlichen Orthologen von Atm1 aus der Hefe, zurückzuführen ist, ist die Eisenspeicherkrankheit XLSA/A (X-chromosomale sideroblastische Anämie und spinozerebelläre Ataxie); weitere Beispiele sind zystische Fibrose (Mukoviszidose) und Adrenoleukodystrophie. Eine funktionelle und strukturelle Aufklärung dieser Proteine ist daher in jeder Hinsicht eine wichtige Basis für die Entwicklung entsprechender Medikamente.












